【論文、高知大学】ワクチン接種後の水痘帯状疱疹ウイルス感染はスパイクタンパクが関連 2022-09-09

◆佐野栄紀特任教授らの研究チームの論文が「Journal of Cutaneous Immunology and Allergy」に掲載されました
2022年9月9日
高知大学医学部皮膚科学講座の山本真有子助教と佐野栄紀特任教授らの研究チームの論文が、ワイリー社のオンライン雑誌「Journal of Cutaneous Immunology and Allergy」に掲載されました。
本邦では、国民の8割以上が2021年より開始された新型コロナウイルス(COVID-19)のmRNAワクチンの2回目接種を完了していますが、皮膚障害を含む様々な副作用が多数報告されています。
佐野栄紀特任教授らは、ワクチン接種後に皮膚症状が発現した患者の皮疹部を調べた結果、COVID-19のスパイク蛋白(※)が検出されたことから、ワクチンの副作用としてmRNAがコードするスパイク蛋白が皮膚病態に関与している可能性を示唆しました。
本研究は皮膚での検討でしたが、今後臓器で発現するスパイクにおいても同様に証明することができれば、mRNAワクチンによる臓器別副作用の証拠となりうるかもしれません。
<論文名>
Persistent varicella zoster virus infection following mRNA COVID-19 vaccination was associated with the presence of encoded spike protein in the lesion
<和 訳>
新型コロナワクチン接種後に生じた遷延性水痘帯状疱疹ヘルペス感染症の皮疹部にワクチンmRNAがコードするスパイク蛋白が存在した
高知大学のプレスリリース
論文はこちら
https://onlinelibrary.wiley.com/doi/epdf/10.1002/cia2.12278
新型コロナワクチン接種後に生じた遷延性水痘帯状疱疹ヘルペス感染症の皮疹部にワクチンmRNAがコードするスパイク蛋白が存在した
概要
バックグラウンド
COVID-19 に対するワクチン接種キャンペーンが開始されて以来、ワクチン接種後のさまざまな皮膚への悪影響が世界中で記録されています。 水痘帯状疱疹ウイルス (VZV) の再活性化は、mRNA COVID-19 ワクチン、特に BNT162b2 の投与後の男性で最も頻繁に見られる皮膚反応であると報告されています。
目的
BNT162b2 ワクチンを 3 か月以上にわたって接種した後、皮膚病変が持続した患者は、VZV ウイルスとワクチン由来のスパイクタンパク質の関与について調査されました。
材料と方法
VZV ウイルスおよび mRNA COVID-19 ワクチンによってコードされるスパイクタンパク質を検出するための免疫組織化学。 VZV ウイルスの PCR 解析。
結果
VZV感染の診断は、PCR分析と免疫組織化学を使用してこれらの病変に対して行われました。 驚くべきことに、COVID-19 ウイルスのワクチンにコードされたスパイクタンパク質は、真皮の小胞ケラチノサイトと内皮細胞で発現していました。
討論
COVID-19 の mRNA ワクチン接種は、免疫系を乱すことで持続的な VZV の再活性化を誘発する可能性がありますが、発現したスパイクタンパク質が病原性の役割を果たしているかどうかは、とらえどころのないままでした。
結論
mRNA COVID-19 ワクチン接種後の持続的な VZV 感染の症例と、感染した皮膚にスパイクタンパク質が存在する症例を提示しました。 ワクチンの副作用のさらなる警戒と SP の役割の調査が必要です。
1 はじめに
2019 年に中国から広まった重症急性呼吸器症候群コロナウイルス 2 (SARS-CoV-2 または COVID-19) の世界的大流行は、COVID-19 ワクチンの開発を促しました。 これまで、COVID-19 ワクチン接種後の多くの皮膚反応が世界中で報告されており、注射部位反応またはいわゆる COVID アーム、蕁麻疹反応、麻疹様発疹、膀胱丘疹病変、バラ色粃糠疹様病変、紫斑、血管炎、血栓、潰瘍などがあります。 、およびヘルペスウイルスの再活性化。 1、2 _ _
以前の研究では、最も頻繁に見られた皮膚反応は、女性の COVID アーム (38.1%) と男性の水痘帯状疱疹ウイルス (VZV) の再活性化 (20%) であることが明らかになりました。 2 COVID-19 ワクチン接種に関連した皮膚反応 (以下、CVSR と呼ぶ) の mRNA の根本的な病因メカニズムは、ほとんど不明なままです。 CVSR は、COVID-19 感染自体に関連するものと似ていることに注意してください。 1 – 3 VZV の再活性化は、老化や免疫抑制剤、HIV 感染、または悪性腫瘍による免疫不全状態などの免疫疲労下で頻繁に発生します。 COVID-19 感染と COVID-19 ワクチン接種の両方に関連する VZV 再活性化に関する報告は、VZV に対する細胞性免疫の調節不全が潜伏状態からの再活性化を可能にすることを示唆しています。 2 , 4 , 5 ここでは、COVID-19 ワクチン接種後の持続的な VZV 感染の症例を提示します。
2 ケースプレゼンテーション
プレドニゾロン (毎日 5 mg)、タクロリムス (毎日 1.5 mg)、およびメトトレキサート (毎週 10 mg) による治療下で関節リウマチ (RA) を患っていた 64 歳の男性が、両方の脚と手に痛みを伴う皮疹を発症しました。 . 噴火は、COVID-19 の mRNA ワクチンである BNT162b2 の初回投与から 13 日後に始まりました。 BNT162b2ワクチンの2回目の接種後に病変が悪化し、2日後に当院に紹介されました。 初診時、脚に膀胱丘疹、右手背部に壊死結節、左膝窩に壊死性結節が見られた(図 1A )。 彼には発熱や全身症状はありませんでした。 臨床検査では、凝固異常を示唆するdダイマーの軽度の増加を除いて、血球数、肝臓、または腎機能に顕著な変化は見られませんでした。 患者には痛みを伴う膀胱丘疹病変があったため、単純ヘルペスの診断の下で、経験的にバラシクロビルを 1 日 1000 mg の用量で 5 日間治療しました。 しかし、それはわずかに効果的でした。 次に、左膝窩の壊死結節から生検を行いました。 組織病理学は、好中球、白血球減少症、フィブリン滲出、血管外漏出赤血球、および微小血栓による炎症性浸潤を伴う真皮の中間から深部における壊死性表皮および根底にある閉塞性血管障害を明らかにした(図 1B、C )。 また、皮下脂肪組織へのリンパ球浸潤も見られました (図 1D )。 壊死性血管炎の組織学的診断がなされた。 発症88日目には、膀胱丘疹病変の一部が壊死性結節に変化し(図 2A )、両脚に新たに発生した赤い斑点に水疱群が形成されました(図 2B )。 さらに、表在性血栓性静脈炎であると疑われる、彼の右膝窩に、触知可能な、ひも状の圧痛のある皮下結節がありました (図 2C )。 膀胱丘疹の噴出は生検され、組織病理学は、真皮の血管の周りに浸潤する巨細胞および単核細胞に関連する表皮内小胞を明らかにした(図 2D )。 抗VZVによる免疫染色は、小胞内の変性ケラチノサイトに対して陽性であり、VZV感染の最終診断を下しました(図 2E )。 そこで、2 ヶ月間隔の初期段階と後期段階でそれぞれ採取した 2 つの生検標本、すなわち壊死性結節と小胞から抽出した DNA を使用した PCR で VZV を確認しました(図 2F )。 私たちは彼をバラシクロビルで毎日 3000 mg の用量で 7 日間治療したところ、彼の皮膚病変はすべて改善されました。 一緒に、私たちは彼を 3 か月も持続する多皮膚性 VZV と診断しました。 したがって、最近報告されたように、mRNA COVID-19 ワクチン接種後、散発性壊死結節と痛みを伴う皮下結節も VZV 関連の小血管血管炎と診断されました。 6


彼の病変と、発症の 13 日前と 8 日後に投与された mRNA COVID-19 ワクチン接種との関連が疑われたため、病変におけるエンコードされたスパイクタンパク質の発現を調査しました。 驚くべきことに、抗コロナウイルススパイクタンパク質(SP)抗体を用いた免疫染色により、表皮の小胞内細胞(図 3A、B )および真皮の炎症血管の内皮細胞(図 3A、C、D )におけるSP発現が明らかになりました。 この研究では二重染色戦略が実行されなかったため、VZV感染ケラチノサイトがSPタンパク質を共発現したかどうかは特定されませんでした。 さらに、SPは、ヘルペス血管炎病変の下にある皮下脂肪組織の細静脈の内皮細胞にも見られました(図 S1 )。 SP 発現は、抗体の非特異的染色によるものではないことに注意してください。これは、VZV 発現が明確に検出された一方で、mRNA COVID-19 ワクチンとは無関係の患者の小胞病変で同じ抗体によってシグナルが観察されなかったためです (図 S2 )。

3 ディスカッション
一般に、無傷の細胞性および体液性免疫は、ウイルスの再感染に対する保護において主要な役割を果たします。 しかし、最近の研究では、体液性免疫ではなく細胞性免疫が VZV 再活性化の保護に不可欠であることが明らかになりました。 7 VZV の再活性化は、最も頻繁に発生する CVSR の 1 つと報告されています。 2 VZV の再活性化と mRNA の COVID-19 ワクチン接種との関係は不明のままですが、細胞性免疫の調節不全が病原性の役割を果たしている可能性があります。 2 、 4 、 5 、 8 さらに、最近の研究では、ワクチン接種後の播種性多皮膚 VZV 感染の症例が示されました。 9 本研究は、多皮膚小胞、壊死性血管炎および表在性血栓性静脈炎様病変を含む非典型的な臨床症状を示す持続性 VZV 感染の非常にまれな症例を表しており、これはおそらく BNT162b2 の 2 回投与に関連して 3 か月も持続した。 COVID-19 感染に関連した VZV の再活性化も報告されており、これには多皮膚性帯状ヘルペス (HZ) および血管炎を模倣する非定型 HZ が含まれていました。 10、11 は、 COVID -19 感染と mRNA COVID-19 ワクチンの両方によって誘発される共通の状態である可能性を示唆しています。 4 したがって、SP は、VZV の再活性化とその持続、および皮膚の血管障害と血栓症を可能にする免疫抑制の原因である可能性があります。 12、13 の COVID -19 ワクチン接種に関連する VZV 再活性化が、免疫抑制薬で治療された関節リウマチ (RA) を含む自己免疫疾患患者で優先的に発生したことが明らかになりました。 14、15 ます 。 私たちの RA 患者は、プレドニゾロン、タクロリムス、およびメトトレキサートを 10 年以上服用しており、mRNA ワクチン接種後の VZV 感染の長期化に寄与した可能性があり VZV の活性化が数か月以上持続する症例が 3 つの文献に記載されており、そのうち 2 例は HIV 感染を併発し 16 , 17 、もう 1 例はリンパ腫の化学療法の結果として重度の免疫不全状態にあり、CD4 細胞数の減少を示しています。 100/mm以上 3 . 18 しかし、私たちの患者は、COVID-19 ワクチン接種前に RA の治療を受けていたにもかかわらず、臨床的に免疫不全ではなかったため、T 細胞免疫に深刻な影響を与えたと考えられます。
私たちの患者の罹患した皮膚で検出されたSPは、これまでに記載されたことはありません。 確かに、小胞のケラチノ サイトと小胞病変の下にある真皮内皮細胞は、SP を表明しました。 さらに、SPは血管炎病変の内皮細胞にも見られました。 病変におけるSPの病原性役割は不明のままでしたが、BNT162b2のすべてのウリジンヌクレオチドをメチル-シュードウリジンに置換することによるRNAの安定化により、コードされたSPが任意の細胞から持続的に長時間産生される可能性があるというのがもっともらしい仮説でした。皮膚を含む防御免疫システムの微小環境に影響を与えます。 私たちの研究の弱点は、SPの存在が免疫組織化学によってのみ示唆されたことです。 したがって、ウェスタンブロッティングなどの他の方法を使用して SP を識別するには、今後の精査が必要です。
要約すると、mRNA COVID-19 ワクチン接種後の持続的な VZV 感染の症例と、罹患した皮膚における SP の存在を提示しました。 ワクチンの副作用のさらなる警戒と SP の役割の調査が必要です。
以上 機械翻訳







![【2021北海道・秋ツアー】全行程4600kmもくじ[道の駅、ダム、ハイドラCP巡り] 【2021北海道・秋ツアー】全行程4600kmもくじ[道の駅、ダム、ハイドラCP巡り]](https://macmof.com/wp/wp-content/uploads/2021/10/3f08cb1fbdfa0f735b5f4c79057e79bc-80x80.jpg)



![豊富駅[北海道] 珍しい鉄道の救援車が展示されていた、豊富温泉が近い【北海道 2021 秋ツアー】 豊富駅[北海道] 珍しい鉄道の救援車が展示されていた、豊富温泉が近い【北海道 2021 秋ツアー】](https://macmof.com/wp/wp-content/uploads/2021/12/20210927150856126a-80x80.jpg)







 2025年 GWドライブ2600km 【長野、新潟、石川、福井、岐阜、香川】
2025年 GWドライブ2600km 【長野、新潟、石川、福井、岐阜、香川】  2025年4月 九州から東北 4265km 桜ツーリング
2025年4月 九州から東北 4265km 桜ツーリング

 【
【 【
【
 2024年ハイドラまとめ
2024年ハイドラまとめ
















 【2022-07 真夏の東北ツアー1400km(宮城、山形、福島)
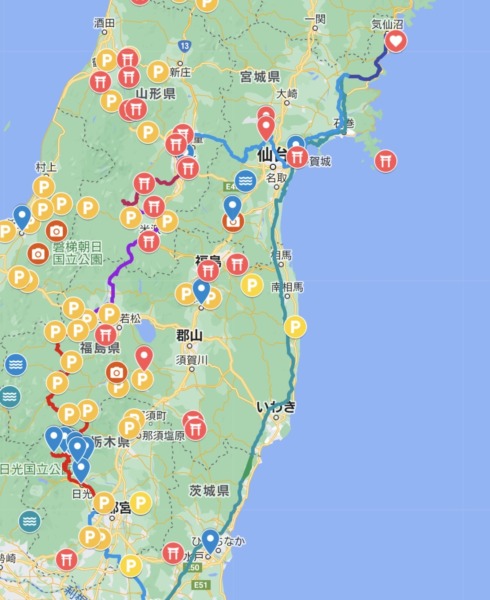
【2022-07 真夏の東北ツアー1400km(宮城、山形、福島)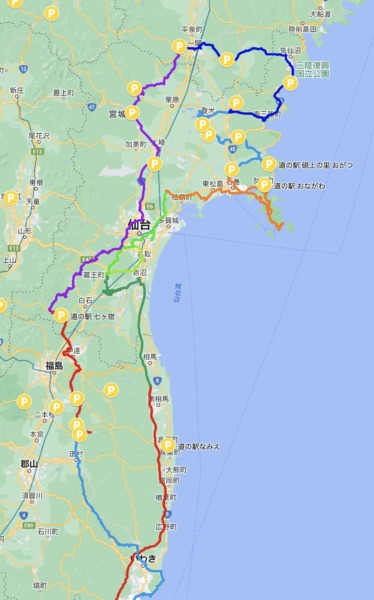 【2022-04 東北お花見ドライブ1400km
【2022-04 東北お花見ドライブ1400km 2022九州・お花見ドライブ3200km
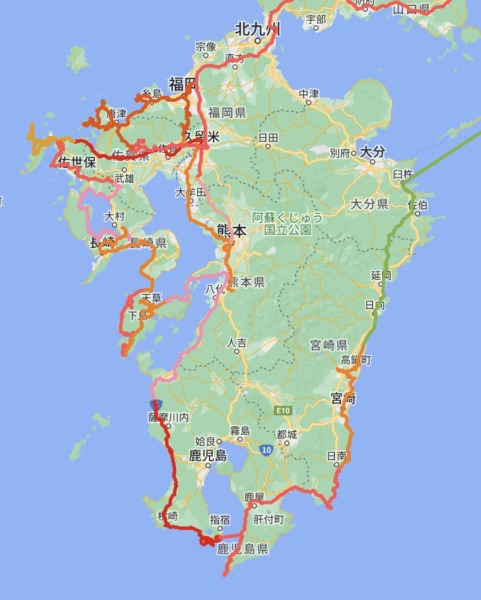
2022九州・お花見ドライブ3200km
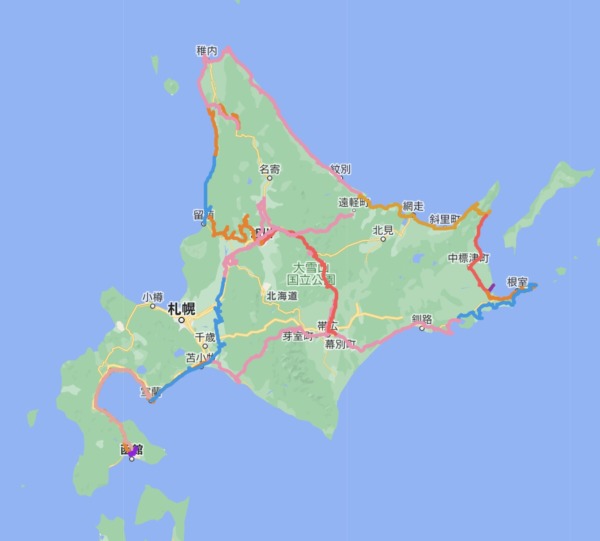
 【2017北海道ドライブ一周4000km】 目次
【2017北海道ドライブ一周4000km】 目次



